Analicemos en este artículo los detalles más interesantes sobre la Segunda ley de la termodinámica y su formulación.
Qué es la Segunda ley de la termodinámica
La segunda ley de la termodinámica establece que la entropía total de un sistema aislado nunca puede disminuir con el tiempo.
La entropía total de un sistema y su entorno pueden permanecer constantes en los casos ideales donde el sistema se encuentra en equilibrio termodinámico, o está experimentando un proceso reversible (ficticio).
En todos los procesos que ocurren, incluidos los procesos espontáneos, la entropía total del sistema y su entorno aumenta y el proceso es irreversible en el sentido termodinámico.
El aumento en la entropía explica la irreversibilidad de los procesos naturales y la asimetría entre el futuro y el pasado.
Históricamente, la segunda ley fue un hallazgo empírico que fue aceptado como un axioma de la teoría termodinámica.
Formas en que se expresa la segunda Ley
La segunda ley se ha expresado de muchas maneras. Su primera formulación se acredita al científico francés Sadi Carnot, quien en 1824 demostró que existe un límite superior a la eficiencia de la conversión del calor en trabajo, en una máquina térmica.
También, las declaraciones clásicas más destacadas son las de Rudolf Clausius (1854), Lord Kelvin (1851) y la declaración en termodinámica axiomática de Constantin Carathéodory (1909).
Entonces, estas declaraciones expresan la ley en términos físicos generales, citando la imposibilidad de ciertos procesos.
Las declaraciones de Clausius y Kelvin han demostrado ser equivalentes.
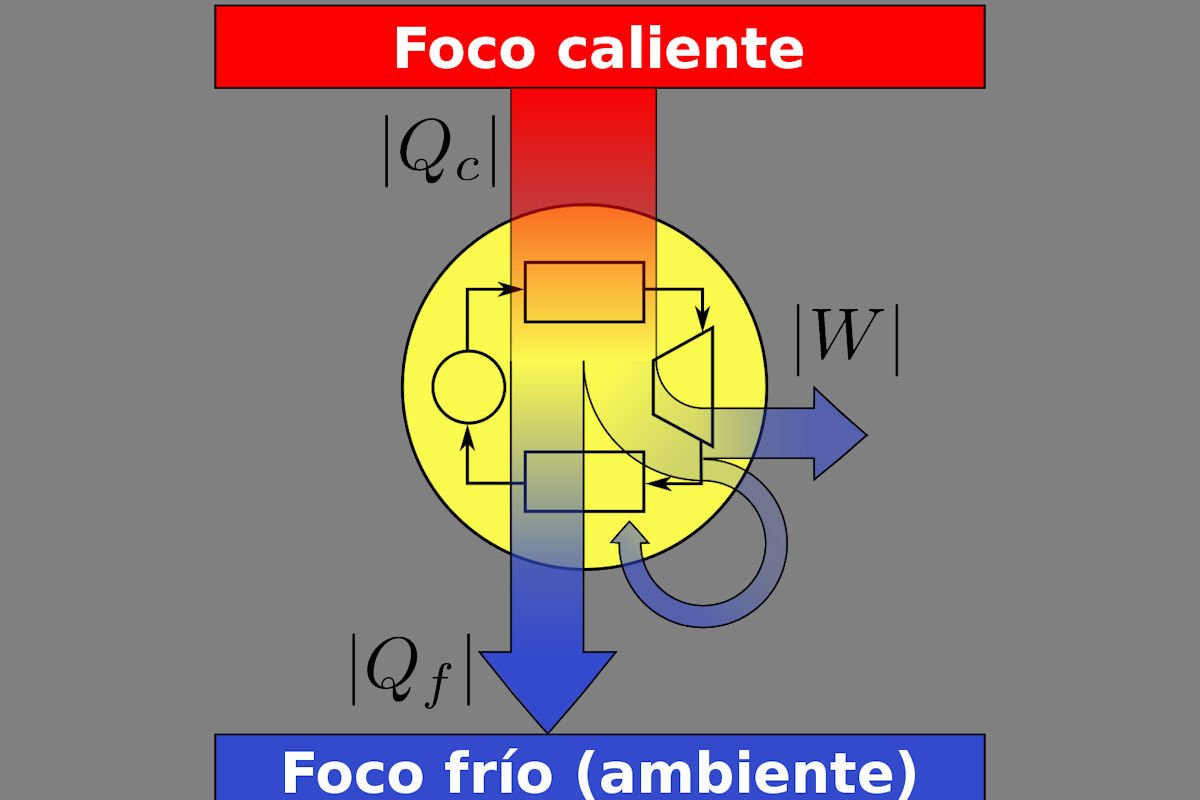
Principio de Carnot
Se refiere al ciclo de un motor térmico de Carnot, operado de manera ficticia en el modo limitante de extrema lentitud conocido como cuasi-estático, de modo que las transferencias de calor y trabajo se realizan entre subsistemas que siempre están en sus propios estados internos de equilibrio termodinámico.
El motor Carnot es un dispositivo idealizado de especial interés para los ingenieros que se preocupan por la eficiencia de los motores térmicos.
Ahora bien, el principio de Carnot fue enunciado en un momento en que la teoría calórica se consideraba seriamente, antes del reconocimiento de la primera ley de la termodinámica y antes de la expresión matemática del concepto de entropía.
Interpretado a la luz de la primera ley, es físicamente equivalente a la segunda ley de la termodinámica, y sigue siendo válido hoy.
En términos modernos, el principio de Carnot puede ser expresado más detalladamente:
«La eficiencia de un ciclo de Carnot cuasi-estático o reversible depende solo de las temperaturas de los dos depósitos de calor, y es la misma, sea cual sea la sustancia de trabajo. Un motor Carnot operado de esta manera es el motor térmico más eficiente posible utilizando esas dos temperaturas.»
Declaración de Clausius
El calor nunca puede pasar de un cuerpo más frío a otro más cálido sin que se produzcan otros cambios conectados al mismo tiempo.
La declaración de Clausius utiliza el concepto de «paso del calor». Esto significa «transferencia neta de energía en forma de calor», y no se refiere a las transferencias contributivas de un modo u otro.
Ahora bien, el calor no puede fluir espontáneamente de las regiones frías a las regiones calientes sin que se realice un trabajo externo en el sistema.
Lo anterior es es evidente por la experiencia ordinaria de la refrigeración.
Por ejemplo, en un refrigerador, el calor fluye de frío a caliente, pero solo cuando es forzado por un agente externo, el sistema de refrigeración.
Declaración de Kelvin
Lord Kelvin expresó la segunda ley de la termodinámica al señalar que es imposible, por medio de una agencia de material inanimado, derivar un efecto mecánico de cualquier porción de materia enfriándola por debajo de la temperatura del más frío de los objetos circundantes.
Ejemplo de la Segunda ley de la termodinámica
El cuerpo humano obedece las leyes de la termodinámica. Piensa en la siguiente situación: estar en una habitación pequeña con muchas otras personas.
Es muy probable que en esas circunstancias, comiences a sentir calor y empieces a sudar. Este es el proceso que tu cuerpo usa para refrescarse.
El calor de tu cuerpo se transfiere al sudor. A medida que el sudor absorbe más y más calor, se evapora de su cuerpo, se vuelve más desordenado y transfiere calor al aire, que calienta la temperatura del aire de la habitación.
Muchas personas sudorosas en una habitación abarrotada, el «sistema cerrado», calentarán las cosas rápidamente.
Esta es la primera y la segunda ley de la termodinámica en acción: no se pierde calor; es meramente transferido, y se acerca al equilibrio con la máxima entropía.