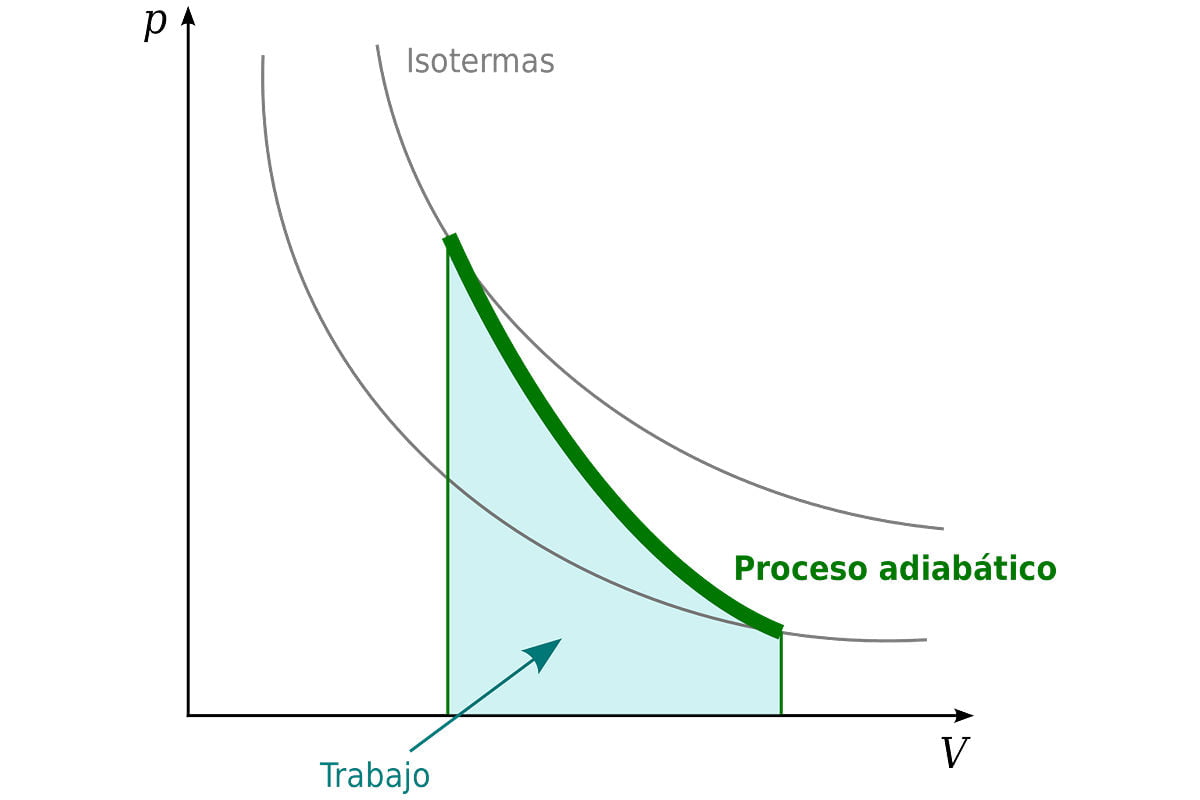
El proceso adiabático proporciona una base conceptual rigurosa para la teoría utilizada para exponer la primera ley de la termodinámica, y como tal, es un concepto clave en la termodinámica.
Qué es el proceso adiabático
Un proceso adiabático ocurre sin la transferencia de calor o masa de sustancias entre un sistema termodinámico y sus alrededores.
En un proceso adiabático, la energía se transfiere al entorno solo como trabajo.
Algunos procesos químicos y físicos ocurren tan rápidamente que pueden describirse convenientemente con el término «aproximación adiabática», lo que significa que no hay tiempo suficiente para que la transferencia de energía como calor tenga lugar hacia o desde el sistema.
a parcela comprimida se calienta y permanece insaturada.
Descripción del proceso adiabático
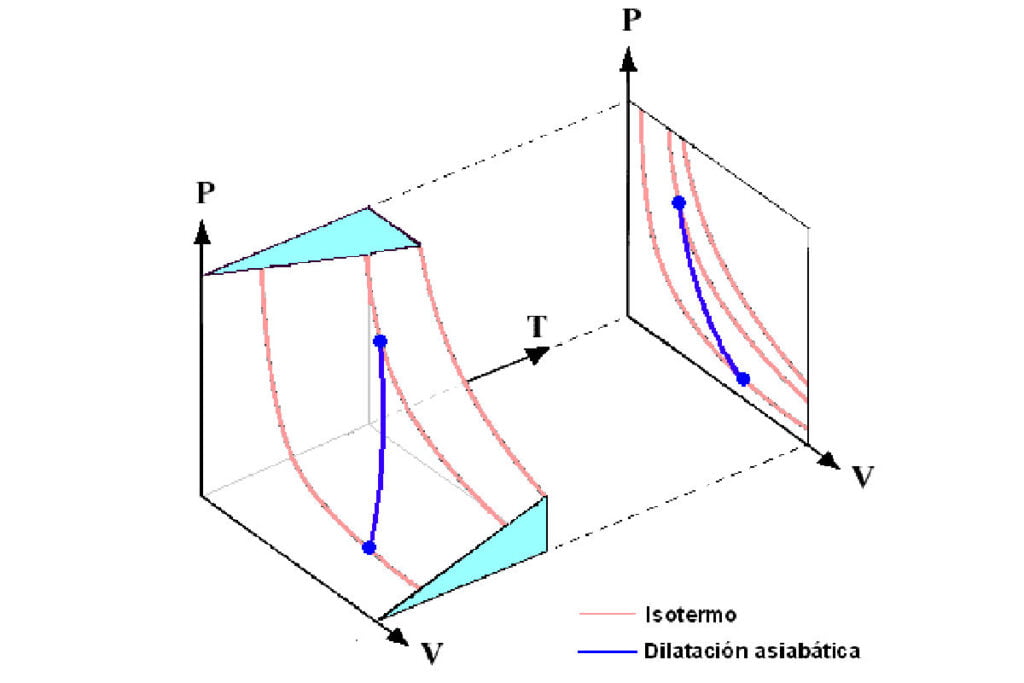
Un proceso que no implica la transferencia de calor o materia dentro o fuera de un sistema, por lo que Q = 0, se denomina proceso adiabático, y se dice que dicho sistema está adiabáticamente aislado.
La suposición de que un proceso es adiabático es una suposición simplificadora hecha con frecuencia.
Por ejemplo, se supone que la compresión de un gas dentro de un cilindro de un motor ocurre tan rápidamente que en la escala de tiempo del proceso de compresión, poca energía del sistema puede transferirse como calor a los alrededores.
Aunque los cilindros no están aislados y son muy conductores, ese proceso está idealizado para ser adiabático. Se puede decir que lo mismo es cierto para el proceso de expansión de tal sistema.
El supuesto de aislamiento adiabático de un sistema es útil y, a menudo, se combina con otros para hacer posible el cálculo del comportamiento del sistema.
Tales suposiciones son idealizaciones.
El comportamiento de las máquinas reales se desvía de estas idealizaciones, pero el supuesto de tal comportamiento «perfecto» proporciona una primera aproximación útil de cómo funciona el mundo real.
Según Laplace, cuando el sonido viaja en un gas, no hay tiempo para la conducción del calor en el medio, por lo que la propagación del sonido es adiabática.
Para tal proceso adiabático, el módulo de elasticidad (módulo de Young) se puede expresar como E = γP, donde γ es la relación de calores específicos a presión constante y a volumen constante (γ =Cp/CV) y P es la presión del gas.
Aplicaciones de la asunción adiabática
Para un sistema cerrado, uno puede escribir la primera ley de la termodinámica como: ΔU = Q – W.
Donde ΔU denota el cambio de la energía interna del sistema, Q la cantidad de energía agregada como calor, y W el trabajo realizado por el sistema en su entorno.
Cuando las paredes del sistema son o no adiabáticas
1. Si el sistema tiene paredes rígidas, el trabajo no se puede transferir hacia adentro o hacia afuera (W = 0), las paredes del sistema no son adiabáticas y la energía se agrega en forma de calor (Q> 0), y no hay cambio de la temperatura del sistema aumentará.
2. Si el sistema tiene paredes rígidas, el trabajo de presión-volumen no se puede realizar y las paredes del sistema son adiabáticas (Q = 0), pero la energía se agrega como trabajo isocórico en forma de fricción o agitación de un fluido viscoso dentro del sistema (W <0), y no hay cambio de fase, la temperatura del sistema aumentará.
Cuando el proceso es o no isentrópico
3. Si las paredes del sistema son adiabáticas (Q = 0), pero no rígidas (W ≠ 0) y, en un proceso idealizado ficticio, se agrega energía al sistema en forma de trabajo de presión-volumen sin fricción y no viscoso (W <0), y no hay cambio de fase, la temperatura del sistema aumentará.
Dicho proceso se denomina proceso isentrópico y se dice que es «reversible».
Si el proceso se invierte, la energía se puede recuperar por completo como el trabajo realizado por el sistema.
4. Si el sistema contiene un gas compresible y se reduce su volumen, la incertidumbre de la posición del gas se reduce y aparentemente reduciría la entropía del sistema, pero la temperatura del sistema aumentará a medida que el proceso es isentrópico (S = 0).
5. Si el trabajo se agrega de tal manera que las fuerzas de fricción o viscosas operen dentro del sistema, entonces el proceso no es isentrópico, y si no hay cambio de fase, la temperatura del sistema aumentará, se dice que el proceso es «irreversible», y el trabajo agregado al sistema no es completamente recuperable en forma de trabajo.
Ejemplos de proceso adiabático
A modo de ejemplo, la temperatura de la llama adiabática es una idealización que utiliza la «aproximación adiabática» para proporcionar un cálculo del límite superior de las temperaturas producidas por la combustión de un combustible.
La temperatura de la llama adiabática es la temperatura que se lograría con una llama si el proceso de combustión se llevara a cabo en ausencia de pérdida de calor en los alrededores.
En meteorología y oceanografía, el proceso de enfriamiento adiabático produce condensación de humedad o salinidad y la parcela se sobresatura.
Por lo tanto, es necesario quitar el exceso. Allí, el proceso se convierte en un proceso pseudo-adiabático en el que se supone que el agua / sal líquida que se condensa se elimina tan pronto como se forma, por precipitación instantánea idealizada.
El proceso pseudoadiabático solo se define para la expansión, ya que un