¿Qué es la termodinámica química? ¿Cuál es la historia de la termodinámica química? Conoce las respuestas a estas y otras preguntas leyendo este artículo.
Definición de termodinámica
Antes de poder comprender el significado de la termodinámica química es necesario saber a qué se dedica la termodinámica como ciencia.
En principio, tenemos que la termodinámica es una de las muchas partes que componen y se encarga de estudiar los fenómenos en los que existe transformación de energía mecánica en energía calorífica o viceversa.
Qué es la termodinámica química
La termodinámica química es el estudio de la interrelación entre el calor y el trabajo con reacciones químicas, o también con cambios físicos del estado dentro de los confines de las leyes termodinámicas.
Esta no solo involucra mediciones de propiedades químicas dentro del laboratorio y las áreas de trabajo, sino que también involucra dentro de sí las aplicaciones de diversos métodos matemáticos al estudio de preguntas químicas y reacciones de los procesos.
Leyes de la termodinámica química
Sus tres leyes son:
- La energía del universo es constante
- En cualquier proceso espontáneo siempre hay un incremento de la entropía en el universo
- La entropía de un cristal perfecto en el 0 kelvin es cero.
Aplicaciones de la termodinámica química
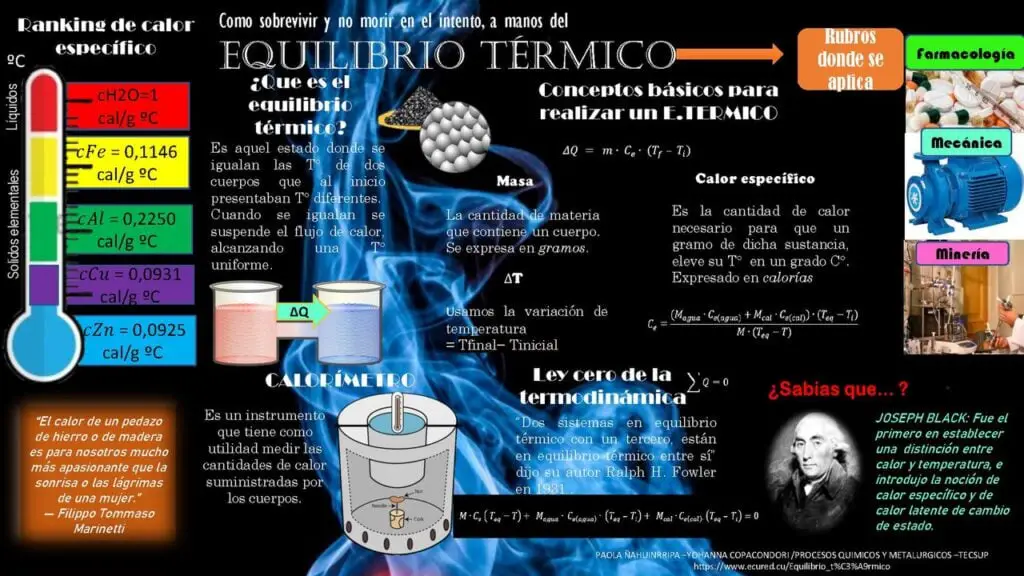
La termodinámica química parte del objetivo principal que es la creación o fabricación de un criterio para así determinar su vialidad, espontaneidad de una transformación.
Así, es comúnmente utilizada para predecir los intercambios de energía que ocurren en los siguientes procesos:
- Reacciones químicas
- Cambios de fase
- La formación de soluciones
Las siguientes funciones de estado son la principal preocupación en la termodinámica química:
- Energía interna
- Entalpía
- Entropía
- Energía libre de Gibbs
Estas entidades de la termodinámica química surgen en su mayoría de la aplicación de la primera y la segunda ley de la termodinámica.
En muchos casos de interés, dentro de la termodinámica química existen grados de libertad internos. Estos procesos son a su vez como reacciones químicas y transiciones de fase, las cuales generan en un 100% de las veces entropía.
La única forma de que no hagan esto y lleguen a tener un cambio, sucede por encontrarse en equilibrio o mantenidas en un equilibrio constante, a través de cambio cuasi estáticos.
Al llegar a ser sumados a dispositivos de forma limitante como por ejemplo pistones o electrodos, con el fin de entregar y recibir trabajo externo, incluso entre estos para materiales «bulto» homogéneos, estos tienen las funciones de energía libre, y dependen de la composición, así como potenciales termodinámicos extensivos, incluyendo la energía interna.
Si las cantidades, en el número de especies químicas son sacadas fuera de la fórmula. Por lo que es imposible describir cambios al final en la composición.
Historia de la termodinámica química
En el año 1865 el físico alemán Rudolf Clausius, formuló la Teoría Mecánica del Calor y sugirió que los principios de la termoquímica, por ejemplo el calor producido en reacciones de combustión, podían ser aplicados a los principios de la termodinámica.
No obstante, entre los años 1873 y 1876 Josiah Willard Gibbs publicó una serie de tres artículos, siendo el más famoso de ellos el titulado «En el Equilibrio de Sustancias Heterogéneas».
En estos artículos, Gibbs mostró cómo las primeras dos leyes de la termodinámica podían ser medidas de manera gráfica y matemática.
Así estos determinarían tanto el equilibrio termodinámico de las reacciones químicas como a su vez la respectiva tendencia a ocurrir o proceder.
La colección de artículos de Gibbs proporcionó el primer cuerpo unificado de teoremas termodinámicos a partir de los principios desarrollados por otros, tales como Clausius y Sadi Carnot.
A inicios del siglo veinte, dos grandes publicaciones de éxito aplicaron en la justa medida en procesos químicos los principios desarrollados por Gibbs y fue así como se estableció el fundamento para la ciencia de la termodinámica química.
La primera de estas publicaciones fue el libro de texto publicado en 1923 y titulado «Termodinámica y la Energía Libre de las Sustancias Químicas» por Gilbert N. Lewis y Merle Randall.
Gracias a la influencia de este libro se reemplazó el término «afinidad química» por el término «energía libre» en el habla inglesa.
Ahora bien, la segunda publicación fue el libro de 1933 titulado «Termodinámica Moderna por los métodos de Willard Gibbs», escrito por E. A. Guggenheim.
De esta manera, aunque el físico y matemático americano Josiah Willard Gibbs sentó las bases para la termodinámica química, Lewis, Randall y Guggenheim son considerados como los fundadores de la termodinámica química moderna debido a la gran contribución que generaron sus libros en unificar la aplicación de la termodinámica a la química.

