La entalpía es la expresión preferida de los cambios de energía del sistema en muchas mediciones químicas, biológicas y físicas a presión constante, porque simplifica la descripción de la transferencia de energía.
Pero qué es la entalpía, puede ser medida, cuáles son sus aplicaciones, todo eso lo explicamos a continuación.
Definición de entalpía
La entapía es una propiedad de un sistema termodinámico que es igual a la energía interna del sistema más el producto de su presión y volumen.
También se define como una función de estado que depende solo del estado de equilibrio prevaleciente identificado por la energía interna, la presión y el volumen del sistema. Es una cantidad extensa.
En un sistema cerrado para evitar la transferencia de materia, para procesos a presión constante, el calor absorbido o liberado equivale al cambio de entalpía.
Esta propiedad comprende la energía interna de un sistema, que es la energía requerida para crear el sistema, más la cantidad de trabajo requerido para hacer espacio para él al desplazar su entorno y establecer su volumen y presión.
Técnicamente, se le define como la integral de la capacidad de calor a una presión constante desde el cero absoluto hasta la temperatura de interés, incluidos los cambios de fase.
¿Se puede medir la entalpia?
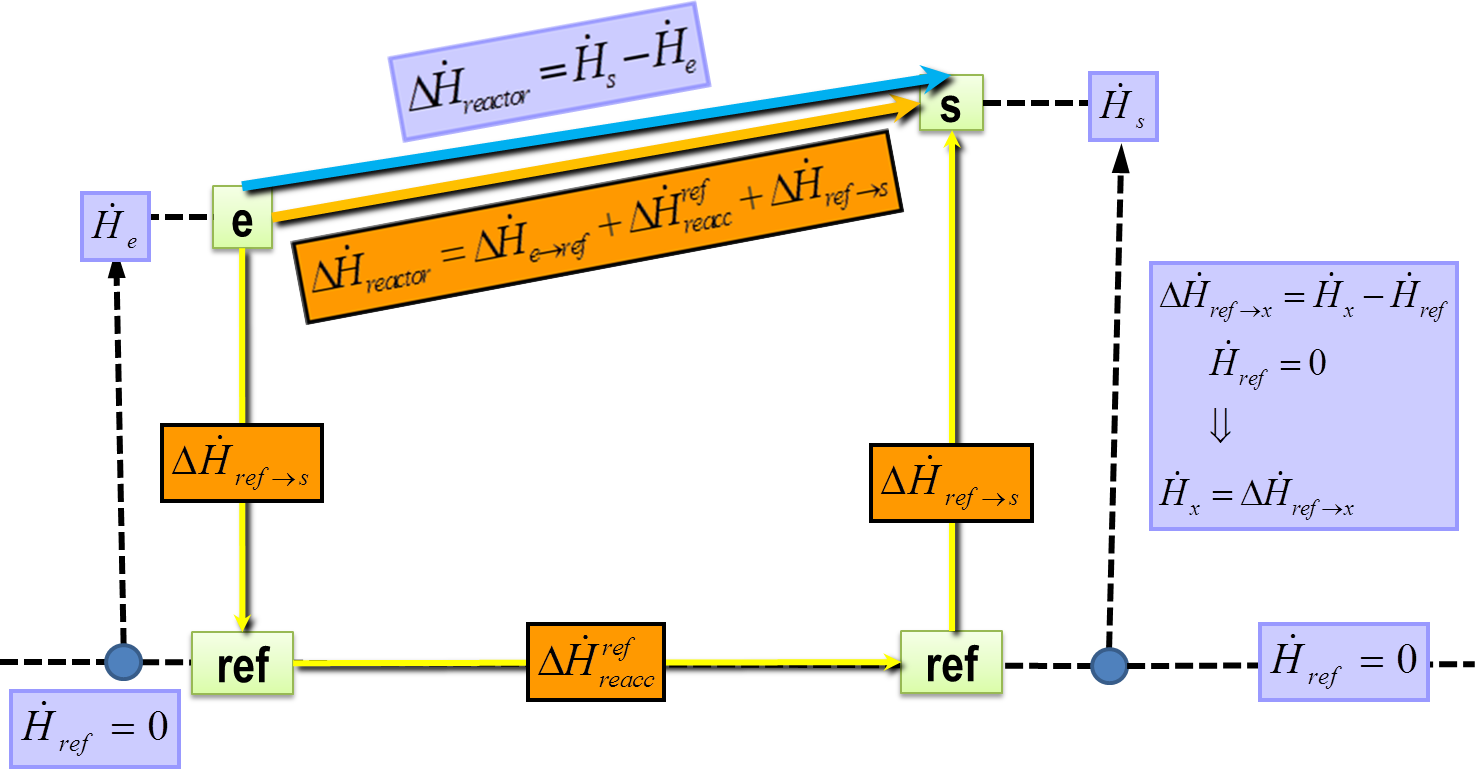
La entalpía total (H) de un sistema no se puede medir directamente porque en sí es un potencial termodinámico, por lo que para medirla debemos referirnos a un punto de referencia definido.
Esta propiedad no es una propiedad física, depende de la temperatura y es una medición del contenido de energía.
La entalpía no puede producir un cambio físico porque para que haya un cambio de entalpía, debería haber un cambio en una propiedad física térmica llamada temperatura.
El día que escuchas a alguien decir que me han golpeado con una piedra y que la piedra tenía una gran entalpía, tal vez podamos medirla físicamente.
Por lo tanto, lo que medimos es el cambio en la entalpía, ΔH.
El ΔH es un cambio positivo en las reacciones endotérmicas y negativo en los procesos exotérmicos que liberan calor.
La unidad de medida relacionado con la entalpía en el Sistema Internacional de Unidades (SI) es el Joule. Otras unidades convencionales históricas aún en uso incluyen la unidad térmica británica (BTU) y la caloría.
¿En qué se diferencia la entalpía del calor?
La entalpía es lo que a veces se denomina energía química: la energía potencial encerrada dentro de una sustancia como resultado de su unión.
Durante una reacción exotérmica, la energía química que se encuentra dentro de una sustancia, disminuye a medida que esta forma de energía se transforma en energía térmica, lo que hace que las sustancias y su entorno se calienten. Se satisface la conservación de la energía.
Durante una reacción endotérmica, la entalpía aumenta: los productos tienen más energía química que los reactivos. Esta energía tiene que venir de algún lugar, por lo que se toma de los alrededores, lo que pierde energía de calor como resultado.
¿Por qué es una propiedad extensa?
Primero, una propiedad extensa es aquella que depende de la cantidad de material presente. Por ejemplo, la masa es una propiedad extensa porque si se duplica la cantidad de material, la masa se duplica.
Una propiedad intensiva es aquella que no depende de la cantidad de material presente. Ejemplos de propiedades intensivas son la temperatura T y presión P.
La entalpía es una medida del contenido de calor, por lo que cuanto mayor es la masa de cualquier sustancia, mayor es la cantidad de calor que puede mantener a cualquier temperatura y presión en particular.
Tratemos de comprender esto con un ejemplo:
Si dos muestras son idénticas a la misma temperatura y presión, excepto que la muestra B tiene el doble de masa que la muestra A, entonces la entalpía de la muestra B es el doble que la muestra A.
Aplicaciones reales de la Entalpía
La entalpía se puede utilizar en una variedad de leyes y ecuaciones. El cambio de entalpía se puede aplicar a los refrigeradores y calentadores de manos.
En una nevera, se evaporan refrigerantes como el freón. La entalpía de vaporización (cambio de energía de líquido a gas) es equivalente a la frialdad de sus alimentos.
Algunas personas usan paquetes de calor químico (calentadores de manos) afuera. Cuando agitas el paquete, comienza a calentar tus manos. Varios reactivos dentro del paquete están expuestos al aire. Este es otro ejemplo de cambio en la entalpía.