La física como ciencia está compuesta de una serie de partes o ramas, entre las que están la dinámica, estática, acústica, óptica y la termodinámica, entre otras. Cada una de ellas se enfoca en el estudio de diferentes fenómenos.
En este artículo nos centramos en la termodinámica, veremos qué es, cual es su objeto de estudio, y otros conceptos básicos para poder comprender su alcance.
Qué es la termodinámica
La termodinámica es la parte de la física que estudia los fenómenos en los que existe transformación de energía mecánica en calorífica o viceversa.
Trasformación termodinámica
Los fenómenos mencionados en la definición anterior, reciben el nombre de transformaciones termodinámicas.
Un sistema realiza una transformación termodinámica cuando intercambia energía con el exterior, pasando de un estado inicial a uno final.
En un fenómeno de este tipo son necesarios un sistema y variables termodinámicas.
Sistema termodinámico
Se trata de un cuerpo o conjunto de cuerpos en los que se verifican los procesos que dan lugar al intercambio energético.
En otras palabras, es un cuerpo o conjunto de cuerpos sobre el que se produce una transformación termodinámica.
Variables termodinámicas
Son todas las magnitudes que intervienen en una transformación termodinámica. Como ejemplo de estas variables se encuentran: presión, volumen, temperatura, cantidad de calor y otras.
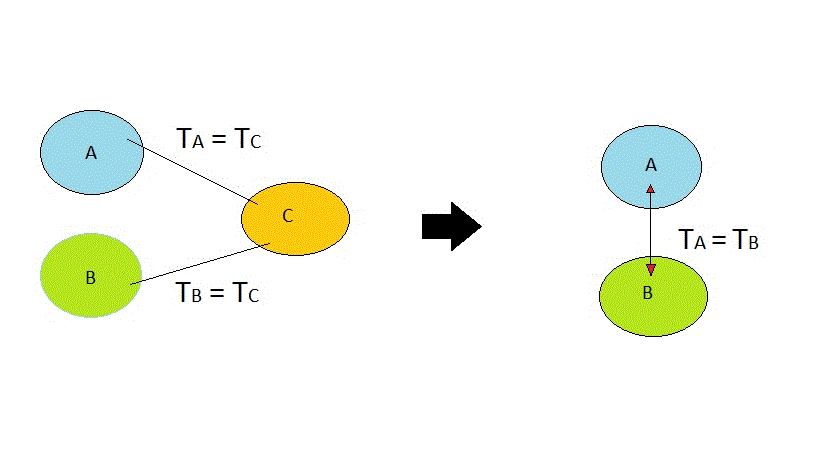
Primer principio de la termodinámica
El principio general de conservación de energía, indica que la energía no se crea ni se destruye, sino que se transforma de una forma a otra.
Esto significa que siempre que desaparece una cantidad de determinado tipo de energía aparece la misma cantidad equivalente de otra forma de energía.
El primer principio de la termodinámica lo que ha hecho es aplicar el principio general que ya se mencionó, en la interconversión concreta calor-trabajo.
El enunciado del primer principio de la termodinámica es:
“La cantidad de calor Q suministrada a un sistema, se invierte en parte en la realización de un trabajo externo L; siendo el resto absorbido por el sistema, ocasionando un aumento ∆U de la energía interna del mismo”.
Dicho enunciado se expresa de la siguiente manera:
Q= L + ∆U
Segundo principio de la termodinámica
El segundo principio de la termodinámica se enuncia así:
«En una transformación termodinámica, el trabajo es postivo cuando el gas se expande; y es negativo en caso contrario”.
Para entender mejor este enunciado, debe tenerse claro que en una trasformación termodinámica, una cantidad de calor se considera positiva cuando es absorbida por el sistema y negativa cuando es cedida por el mismo.
Por su parte, un trabajo se considera positivo cuando es realizado por el sistema y negativo cuando es realizado sobre él.
Tipos de transformaciones termodinámicas
El primer principio de la termodinámica adopta diversas formas según sea la naturaleza de la transformación realizada por el gas, es decir, en función de las condiciones en que tiene lugar el intercambio de energía entre el sistema y el mundo exterior.
De acuerdo a la variable termodinámica que permanezca inalterable, se consideran los tipos de transformaciones que a continuación mencionamos:
- Transformación isóbara: p = C (a presión constante).
- Transformación isócora: V = C (a volumen constante)
- Transformación isoterma: T = C (a temperatura constante)
- Transformación adiabática: Q = C (sin intervalo de calor)
Transformación isóbara
Es aquella en que la presión permanece constante. En una transformación isóbara de un gas perfecto, el volumen es directamente proporcional a la temperatura absoluta.
Transformación isócora
Es aquella en la que el volumen permanece constante. En una transformación isócora de un gas perfecto, la presión es directamente proporcional a la temperatura absoluta.
La consecuencia de que el volumen no pueda cambiar es que no existe la posibilidad de realizar trabajo de expansión ni de compresión del gas.
Además, en este tipo de transformación, el calor suministrado al sistema se emplea en su totalidad en incrementar su energía interna.
En el caso de que sea el gas el que cede el calor, el calor cedido por el sistema repercute en una disminución equivalente de su energía interna.
Transformación isoterma
Es aquella en la que la temperatura permanece constante. En una transformación isoterma de un gas perfecto, la presión es inversamente proporcional al volumen.
En una transformación de este tipo, el calor suministrado al sistema se emplea de forma íntegra en producir trabajo mecánico.
Transformación adiabática
Es aquella en la que no existe intercambio de calor entre el sisema y el medio exterior. En otras palabras, la transformación adiabática es aquella en la que la cantidad de calor del sistema permanece constante.
Cuando ocurre esta transformación, el trabajo realizado por el sistema es igual a la disminución de su energía interna.
Entalpía
La entalpía de un sistema es la suma de su energía interna más el producto de la presión por el volumen.
Se le representa con la letra H, de tal manera que se expresa de esta forma:
H = U + p * V
No es posible medir la entalpía de un sistema en un momento determinado debido a que no es posible medir la energía que posee cada partícula, ni contar el número de estas.
Sin embargo, el hecho de que no pueda medirse carece de importancia debido a que lo que realmente interesa en una transformación termodinámica no es la entalpía inicial y final del sistema, sino la variación de dicha magnitud a lo largo del proceso.
Entropía
El término entropía se refiere a lo que los científicos llaman “la segunda ley de la termodinámica” y se define como “parte de la actividad o energía de un cuerpo o sistema que no se convierte en trabajo.”
La entropía es solo una función de estado del sistema; aumenta o permanece constante en cada transformación que se produce en un sistema aislado.
Usando la noción de entropía se puede reformular el segundo principio de la termodinámica de esta manera “las transformaciones en las que la entropía de un sistema aislado disminuye no son posible”.
Otra forma sería “En cada transformación que se produce en un sistema aislado, la entropía del sistema aumenta o permanece constante.”
La entropía, representada por la letra S, no puede calcularse en términos absolutos, por eso, en la práctica, lo que se hace es calcula el aumento de entropía de un sistema en un determinado proceso.
Cuando un sistema termodinámico recibe una cantidad de calor Q a una temperatura T, se dice que ha sufrido un aumento de entropía, cuyo valor es:
∆S = Q/T
El cálculo de la variación de la entropía que tiene lugar en una transformación termodinámica requiere la utilización del cálculo integral, debido a que en general, la temperatura varía durante el proceso.
Solo en las transformaciones isotermas, es decir, en aquellas transformaciones que como se mencionó antes se producen a temperatura constante; es posible calcular el aumento de entropía mediante operaciones artiméticas.

