En el núcleo del átomo encontramos partículas subatómicas llamadas neutrón y protón, esta última tienen la carga positiva del átomo, exactamente igual en tamaño, pero de la clase contraria a la carga negativa del electrón.
En este artículo hablamos del protón, qué es, cuales son sus principales características y cuál es su antipartícula.
Átomo y núcleo atómico
El átomo es conocido como la partícula elemental, y una definición un poco más amplia indica que es la mínima porción de una sustancia capaz de combinarse químicamente.
Dentro de la estructura atómica tenemos las partículas subatómicas. El átomo a pesar de ser indivisible está formado por varias de estas partículas: protones, neutrones y electrones.
En este sentido, el electrón es la partícula más ligera de las que componen el átomo. Se caracteriza por tener una carga negativa. El protón y el neutrón por su parte no son elementales. Estos constituyen un conjunto de quarks u y d, que son partículas fundamentales.
Los átomos tienen un núcleo y algunos electrones unidos a él. El núcleo está compuesto por protones y neutrones. La carga de los protones es positiva, mientras que la de los neutrones es negativa, los neutrones son neutros, teniendo ambas cargas, tanto positiva como negativa.
Aclarado esto ahora veamos con más profundidad qué es un protón.
Definición de protón
En principio encontremos su origen etimológico. El término protón procede del griego y significa, primero.
Pero ¿qué es el protón? Formalmente se le define como una partícula de carga eléctrica positiva equivalente a la del electrón.
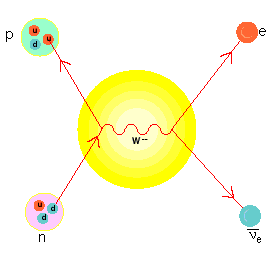
El protón es un barión formado por tres quarks, específicamente dos quark up (arriba) con carga eléctrica cada uno de +2/3 y un quark down (abajo) que tiene carga eléctrica -1/3.
La carga eléctrica elemental final del protón es +1. ( 1,602 × 10–19 Coulomb) y su masa es es de casi un GeV, lo que nos indica que es unas 1.836 veces mayor a la masa del electrón.
Esta partícula fue descubierta en 1918 por Ernest Rutherford, el mismo que también teorizó la existencia del neutrón.
Sin embargo, los trabajos para encontrar el protón comenzaron gracias a Eugen Goldstein en 1886, quien tenía la hipótesis de que si el átomo era eléctricamente neutro, entonces debía tener también partículas cargadas positivamente y no solo electrones (que ya habían sido descubiertos).
La importancia del protón recae en que su número en el núcleo de un átomo, es lo que determina de qué elemento químico se trata y sus propiedades químicas.
Características del protón
- Cuenta un espín y en consecuencia con un momento magnético
- Junto al neutrón se le conoce como nucleones
- Los tres quarks que componen un protón están sujetados entre sí gracias a los gluones, partículas subatómicas que transmiten la llamada fuerza nuclear fuerte.
- Esta partícula subatómica es estable a lo largo de períodos de miles de millones, incluso billones, de años.
- El equivalente en antimateria del protón es el antiprotón, con igual magnitud de carga eléctrica que el protón, pero con signo contrario.
Número atómico
El número atómico de un elemento, representado por la letra Z, se refiere a la cantidad total de protones que tiene el átomo en su núcleo.
Es precisamente el número atómico lo que le da identidad a un elemento y lo diferencia del resto en la tabla periódica.
Por cierto, en la tabla periódica, los distintos elementos está ordenados en orden creciente por su número atómico, de acuerdo con la llamada ley de Moseley (1913).
Veamos algunos ejemplos de números atómicos en distintos elementos metales y no metales:

- Argón (A): Z=18, protones=18, neutrones=18
- Helio (He): Z=2, protones=2, neutrones=2
- Radón (Rn): Z=86, protones=86, neutrones=86
- Flúor (F): Z=9, protones=9, neutrones=9
- Cloro (Cl): Z=17 protones=17, neutrones=17
- Litio (Li): Z=3, protones=3, neutrones=3
- Potasio (K): Z=19, protones=19, neutrones=19
- Magnesio (Mg): Z=12, protones=12, neutrones=12
- Calcio (Ca): Z=20, protones=20, neutrones=20
- Aluminio (Al): Z=13, protones=13, neutrones=13
Al representar un determinado elemento químico, el número atómico (Z), es decir, el número de protones y electrones, se coloca como un subíndice a la izquierda del símbolo del elemento en cuestión.
Antiprotón
Como ya se mencionó, la antipartícula del protón es el antiprotón o protón negativo, que solo se diferencia del protón por tener carga negativa y no formar parte del núcleo del átomo.
La antipartícula es estable en el vacío y no hay indicios de que se desintegre de forma espontánea. No obstante, si choca con un protón, se convertirán en un mesón, una subparticula con promedio de vida muy corto.
El descubrimiento del antiprotón se produjo en 1955 cuando fue identificado por Emilio Segre y Owen Chamberlain en el Laboratorio de Radiación de la Universidad de California (Estados Unidos).

