La mayoría de los elementos químicos son en realidad mezcla de isótopos, pero ¿qué es un isótopo? Conoce a continuación la respuesta a este tema tan interesante.
Número atómico y número másico
Para comprender el tema de los isótopos es necesario saber a qué se hace referencia cuando se habla de número atómico y de número másico de un elemento.
El número atómico de un elemento está determinado por el número de electrones y protones que tenga ese átomo. Es representado con la letra Z.
Por su parte, el número másico, representado con la letra A se define como el número de partículas que el átomo tiene disponibles dentro de su núcleo.
En este sentido, se calcula sumando el número de protones y el número de neutrones de un átomo particular.
Por lo tanto, existe una relación entre el número atómico y el número másico, que indica que este último es igual al número atómico más el número de neutrones. Es decir, A = Z + N.
Qué son los isótopos
Antes de definir qué es un isótopo es importante saber que este término procede del griego, específicamente de la unión de las palabras isos: igual y topos: lugar, tierra o suelo.
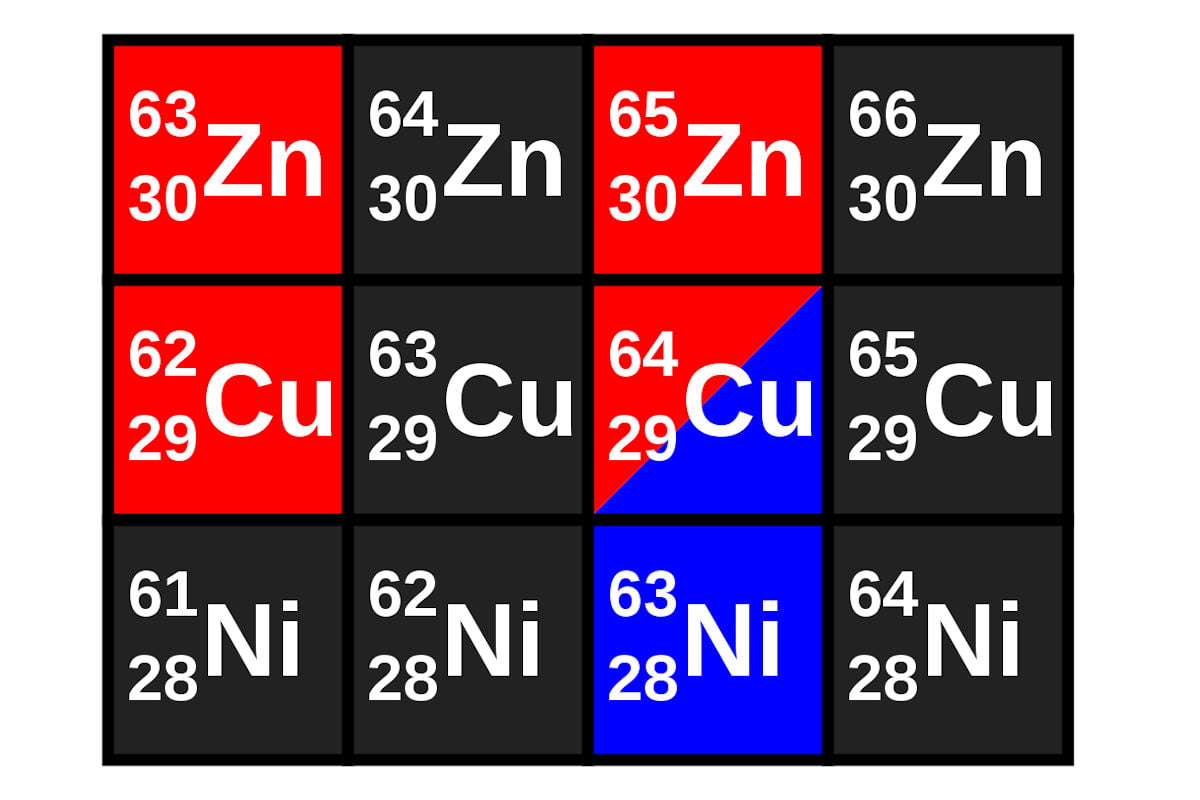
Formalmente se dice que dos átomos son isótopos cuando poseyendo el mismo número atómico, es decir, perteneciendo a un mismo elemento, poseen distinto número másico.
Esto significa que aunque ambos átomos tiene igual número de protones, el número de neutrones de su núcleo es diferente de unos casos a otros.
Prácticamente todos los elementos de la tabla periódica poseen más de un isótopo, pero la excepción son 8 elementos (entre los que están el berilio y el sodio) que poseen un solo isótopo.
Tipos de isótopos
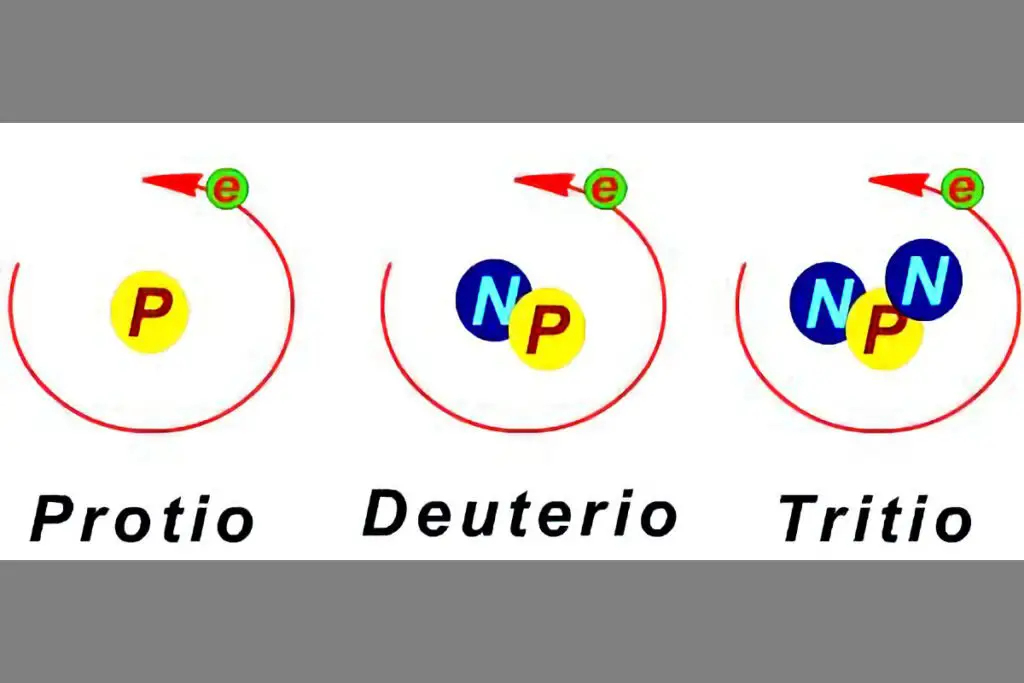
Existen isótopos radiactivos a los que se llama radioisótopos y no radiactivos o estables.
Isotopos radiactivos (radioisótopos)
Los radioisótopos son elementos atómicos que no tienen la proporción correcta de protones y neutrones que los ayuda a permanecer estables. Como resultado de esta cantidad desequilibrada de protones y neutrones, pasan por una etapa de desintegración en la que se emiten rayos beta, alfa o gamma.
Hay que destacar que naturalmente solo existen unos setenta isotopos radiactivos, el resto son obtenidos en laboratorios a través del bombardeo de partículas subatómicas. En general se conocen por lo menos un millar de isotopos de este tipo que son de amplia utilización.
Isotopos estables
En la naturaleza solo existen un poco más de 300 isotopos estables, sin embargo, estos isotopos naturales se encuentran en toda muestra de cualquier elemento que se utilice y siempre en una misma proporción.
Nomenclatura de los isótopos
Para evitar crear miles de nombres nuevos para cada isótopo que se fuese descubriendo, se estableció una sencilla forma de denominarlos: se escribe el símbolo del elemento al que pertenece, y se le coloca como subíndice a su izquierda el número atómico y como superíndice, también a la izquierda, el número másico.
Sin embargo, debido a que el número atómico de todos los isotopos de cualquier elemento será siempre el mismo, es aceptable colocar solo el símbolo del elemento y como superíndice a la izquierda su número másico.
Una tercera notación aceptada consiste en colocar el símbolo del elemento químico y a continuación el número de protones y neutrones del isótopo, separados por un guión. Por ejemplo, U-235 (isótopo de uranio)
Separación de isótopos
La separación de los isótopos que contiene una muestra de un elemento cualquiera, no se puede realizar a través de procedimientos químicos, debido a que todos ellos tienen las mismas propiedades químicas. Por esto es necesario emplear procedimientos físicos.
Uno de esos procedimientos consiste en utilizar un espectógrafo de masas preciso, gracias al cual se pueden identificar los isótopos que contienen loa distintos elementos, debido a la diferencia de masa que existe entre ellos.
Otros métodos físicos para separar los isótopos son difusión, centrifugación, destilación fraccionada y electrólisis.
Descubrimiento del isótopo
El descubrimiento de los isótopos no es un acontecimiento muy lejano, de hecho se ubica en el siglo pasado, específicamente en el año 1911, cuando el nombre es presentado por primera vez por el científico inglés Frederick Soddy, quien realizaba estudios sobre sustancias radiactivas naturales.
Los trabajos de Soddy sobre radiactividad e isotopos fueron reconocidos al ser galardonado, 10 años después de su descubrimiento, con el premio Nobel de Química en 1921.
Usos de los isótopos
Los isotopos radiactivos son los más ampliamente usados en diversos campos, entre los que están
- Agricultura
- Ganadería
- Metalurgia
- Ingeniería de motores
- Medicina
- Investigaciones biológicas
- Antropología
- Geología
- Historia
- Esterilización de alimentos enlatados
- Industria de los plásticos
Por ejemplo, existe la llamada prueba del Carbono 14 con el cual es posible determinar de qué época datan restos arqueológicos.